 Немикробная этиология: реакция на инородное тело, поддерживающая апикальный периодонтит после лечения
Немикробная этиология: реакция на инородное тело, поддерживающая апикальный периодонтит после лечения
Автор: Ramachandran Nair
Перевод с английского языка Анны Потачиц для портала BELODENT.ORG
Полимеразная цепная реакция (ПЦР) – изящная технология для точного воспроизведения и амплификации главной молекулы жизни, и при этом действительно важная научная процедура, без которой полученные данные имеют очень ограниченное значение.
Присутствие микробной инфекции в периапикальнах тканях и в корневых каналах – основная причина возникновения апикального периодонтита после лечения в хорошо залеченных зубах.
Однако в редких случаях немикробные этиологические факторы, локализующиеся за пределами корневых каналов (в воспаленных периапикальных тканях), могут поддерживать патологию в зубах с запломбированными каналами. К факторам, вызывающим реакции на инородные тела, относят экзогенные материалы или кристаллы эндогенного холестерина, кисты и актиномикоз окружающих тканей.
В этой статье рассматривается реакция на инородное тело в периапикальных тканях как патобиологический фактор, поддерживающий течение апикального периодонтита после эндодонтического лечения.
Апикальный периодонтит – это, по существу, заболевание, связанное с инфекцией корневых каналов. Таким образом, рациональное лечение апикального периодонтита заключается в устранении инфекционных агентов из корневого канала (или значительном уменьшении их влияния) и исключении дальнейшего инфицирования канала путем пломбирования корня. Когда корневой канал залечен надлежащим образом, восстановление периапикальных тканей проходит обычно вместе с регенерацией кости, которая характеризуется постепенным уменьшением размеров деструкции на контрольных ренгенограммах.
Тем не менее, по ряду причин, полное восстановление или уменьшение деструкции кости в области апекса может происходить не во всех зубах с запломбированными корнями. В некоторых случаях апикальный периодонтит сохраняется после лечения - состояние, обычно называемое «эндодонтической неудачей».
Общепризнано, что апикальный периодонтит после лечения корневых каналов возникает при недостаточном контроле манипуляций и недостаточном устранении инфекции.
Проблемы, в основном технического происхождения, приводящие к апикальному периодонтиту после лечения, включают: недостаточный контроль асептики, неполноценный доступ (недостаточная величина или неправильная форма полости), пропущенные каналы, некачественные инструменты, недостаточная инструментальная обработка, негерметичность временных или постоянных пломбировок.
Даже при соблюдении самых высоких стандартов и строжайшей техники выполнения, апикальный периодонтит может по-прежнему сохраняться в виде бессимптомной деструкции кости из-за сложности строения системы корневых каналов, сформированной главными и несколькими дополнительными каналами, их апикальными ответвлениями и анастомозами, которые невозможно как следует обработать инструментально, промыть, подвергнуть медикаментозной обработке и запломбировать.
Кроме того, существуют внекорневые этиологические факторы (расположенные за пределами корневых каналов, в воспаленных периапикальных тканях), которые могут препятствовать лечению апикального периодонтита, возникающего после эндодонтии.
Этиология апикального периодонтита, возникающего после лечения и сохраняющегося в виде бессимптомной деструкции кости в хорошо пролеченных зубах, плохо охарактеризована. Ранние исследования периапикальных биопсий были ограничены использованием неподходящих образцов, несоответствующих методов и критериев анализа, которые не давали соответствующей информации об этиологии.
Ограничениями процедуры также являются: световая микроскопия без корреляционного электронно-микроскопического анализа, беспорядочная оценка срезов, погружение образцов в парафин, а не в смолу, и выделение чрезмерно широких критериев, таких как "бактерии и/или остатки", которые могут охватывать множество потенциальных этиологических агентов.
В течение 1990-х годов серия тщательно проведенных исследований, в которых учитывался соответствующий выбор случаев и методов, показала, что существует четыре биологических фактора, которые приводят к асимптоматическому апикальному периодонтиту после лечения:
1) внутрикорневая инфекция, сохраняющаяся в апикальной части корневого канала;
2) внекорневая инфекция, в основном в форме периапикального актиномикоза;
3) реакция на инородное тело, вызванная выведением пломбировочного материала за верхушку корневого канала, другими инородными материалами или кристаллами эндогенного холестерина;
4) кисты.
Следует подчеркнуть, что из всех этих факторов персистирующая инфекция в сложной системе корневых каналов является основной причиной возникновения апикального периодонтита в хорошо залеченных зубах.
В совсем недавнем исследовании с использованием молекулярно-генетического метода во всех 22-х исследованных «бессимптомных» зубах с неясными просветлениями в области апекса, которые образовались после лечения, выявили бактериальную ДНК в образцах, взятых из корневых каналов. В этом контексте невозможно переоценить важность отбора подходящих случаев для исследования.
Например, 5 из 22-х зубов «имели временные (коронковые) реставрации» - фактор, из-за которого возможно повторное бактериальное инфицирование каналов по причине негерметичности пломбы.
Помимо возможного повторного инфицирования и/или контаминации, что может случиться даже в зубах с постоянными коронковыми реставрациями, молекулярный метод не дифференцирует жизнеспособный и нежизнеспособный организмы, но может определять незначительное количество бактериальной ДНК, которая амплифицируется с помощью полимеразной цепной реакции (ПЦР).
Данные, полученные с помощью молекулярного метода, требуют очень точной интерпретации в свете многих преимуществ и многочисленных ограничений метода, чтобы избежать переоценки выводов о том, что все апикальные периодонтиты, возникающие после лечения, вызваны наличием внутрикорневой инфекции.
Еще большая осторожность необходима при интерпретации опубликованных данных о роли неактиномикотических внекорневых инфекций при апикальном периодонтите, поражающем зубы с хорошо запломбированными корнями.
В дополнение к возможным «посторонним» источникам, вызывает опасение контаминация образцов ткани апекса микроорганизмами из инфицированного корневого канала. Это связано с тем, что инфекционные агенты существуют в апикальных отверстиях зубов с первичным и вторичным апикальным периодонтитом. Микроорганизмы могут легко переместиться во время операции и процедуры взятия образцов. Таким образом, контаминированные образцы тканей могут дать положительный результат на наличие инфекции.
Этим можно объяснить новые сообщения о различных микробах в воспаленной периапикальной ткани бессимптомных очагов, полученных с помощью посева и молекулярных методов, несмотря на тщательные асептические хирургические процедуры и процедуры взятия проб.
Помимо проблемы возможной контаминации образцов и неспособности метода различать жизнеспособные и нежизнеспособные организмы, он также не позволяет дифференцировать микроорганизмы в фагоцитирующих клетках от внеклеточных микроорганизмов в периапикальных тканях.
Таким образом, существует проблема взятия образца воспаленной периапикальной ткани и отделения ее от того, что находится на апексе корня. Молекулярно-генетические методы обеспечивают достаточную точность, но они не решают основную проблему правильного взятия образца периапикальной гранулемы без контаминации.
В редких случаях, независимо от незначительного присутствия или полного отсутствия микроорганизмов в каналах, экзогенные материалы, попавшие в периапикальную область, кристаллы эндогенного холестерина, отложившиеся в периапикальных тканях, и кисты могут поддерживать апикальный периодонтит после лечения корневого канала.
Цель этой статьи - предоставить всесторонний обзор реакции на инородное тело в периапексе как патобиологический фактор, который может поддерживать апикальный периодонтит после лечения.
Материалы экзогенной природы как причина реакций периапикальных тканей на инородные тела
Материалы для пломбирования каналов, другие эндодонтические материалы и частички пищи могут достигать периапикальных тканей и вызывать реакцию на инородные тела, которая может проявляться в виде асимптоматической на протяжении многих лет деструкции альвеолярной кости.
Гуттаперча
Наиболее широко используемый филлер для корневых каналов коммерчески получают из гуттаперчи (трансполиизопрена), коагулированного сока дерева Plaquium gutta в Азии или из аналогичного латекса, полученного из дерева Mimisops globsa в Южной Америке. Стоматологические гуттаперчевые штифты состоят примерно из 20% гууттаперчи, 60-75% оксида цинка, различных количеств сульфатов металлов для рентгеноконтрастности, восков и красящих веществ.
Основываясь на экспериментах in vivo по внедрению среди животных, считается, что гуттаперчевые штифты являются биосовместимыми и хорошо переносятся тканями человека. Тем не менее эта точка зрения не согласовывается с клиническими наблюдениями, говорящими, что присутствие гуттаперчи в избытке связано с прерыванием или задержкой восстановления периапикальных тканей.
В общем, объемные порции стерильных материалов с гладкими поверхностями, размещенные внутри кости или мягких тканей, вызывают инкапсуляцию волокнистой ткани, в то время как дисперсные материалы вызывают реакции на инородное тело и хронические воспалительные реакции.
Помимо размера частиц, химический состав гуттаперчи также имеет значение. Было показано, что выщелачивание оксида цинка из гуттаперчевых штифтов является цитотоксичным in vitro, раздражающим ткани in vivo и связанным с сопутствующей воспалительной реакцией.
Реакция тканей на гуттаперчу была специально изучена с использованием подкожно имплантированных тефлоновых частиц, в которых гуттаперча вызывала два различных типа тканевой реакции.
Крупные участки гуттаперчи были хорошо инкапсулированы коллагеном, а окружающие ткани не воспалены. (рис. 1).
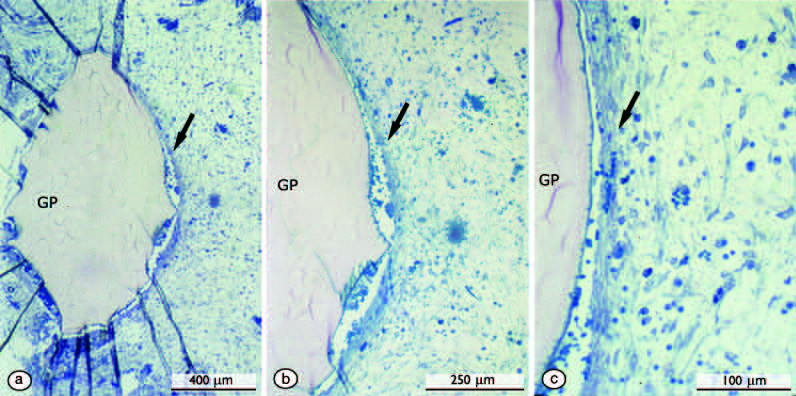
Рис. 1. Реакция тканей морской свинки на гуттаперчу (GP) через 1 месяц после подкожной имплантации (а). Большие частички гуттаперчи хорошо инкапсулированы коллагеновыми волокнами, которые проходят параллельно поверхности частиц гуттаперчи. Граница между частичкой гуттаперчи и тканью хозяина (стрелка) увеличена поэтапно в (b, c). Промежуток между имплантатом и коллагеновой капсулой является искусственным. Обратите внимание на невоспаленную, здоровую мягкую соединительную ткань. Исходные увеличения: (a) 42; (b) 80; (c) 200.
И напротив, мелкие частицы гуттаперчи вызывали интенсивную локализованную тканевую реакцию (рис. 2), характеризующуюся наличием макрофагов и гигантских многоядерных клеток. Скопление макрофагов в сочетании с мелкими частичками гуттаперчи имеет важное значение для клинически наблюдаемого ухудшения при апикальном периодонтите, когда каналы зубов запломбированы избытком гуттаперчи.
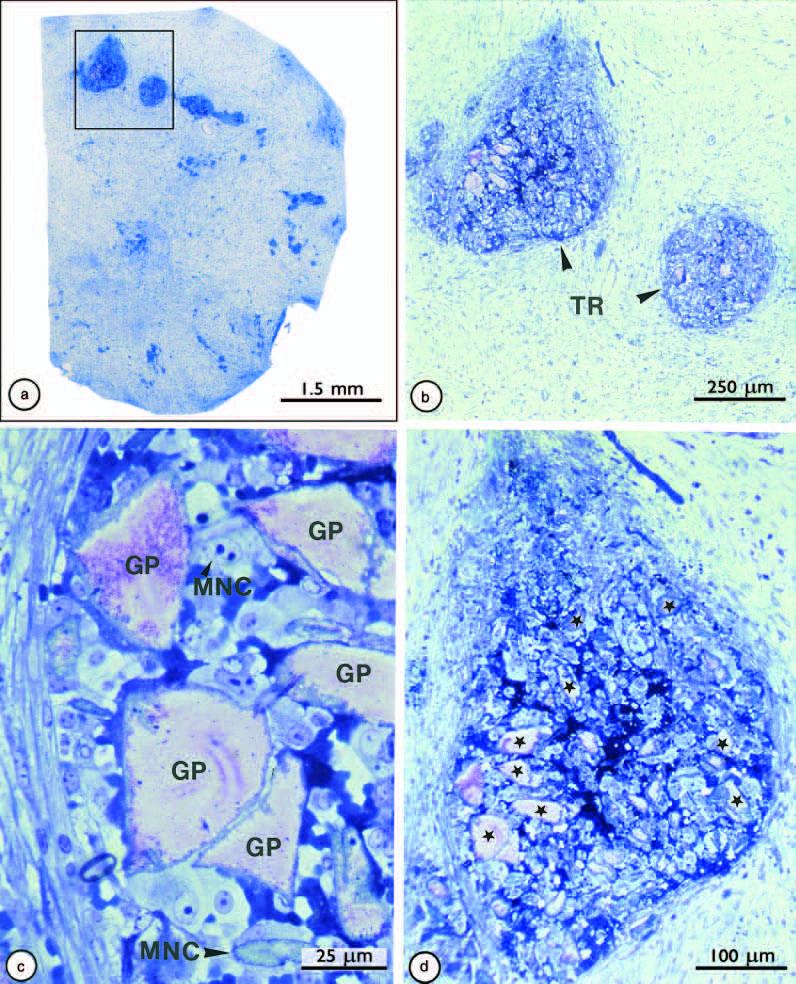
Рис. 2.
Измельченные частицы гуттаперчи, которые обуславливают апикальный периодонтит после лечения. В виде скоплений мелких частиц (a, b) они вызывают интенсивную ограниченную тканевую реакцию (TR) вокруг. Обратите внимание, что мелкие частицы гуттаперчи (GP in c, ● in d) окружены многочисленными мононуклеарными клетками (MNC). Исходные увеличения: (a) 20; (b) 80; (c) 750; (d) 200.
Из: Nair PNR. Патобиология периапекса. В: Cohen S, Burns RC. eds. Pathways of the Pulp, 8 изд. . St Louis: Mosby, 2002.
Частицы гуттаперчиевых штифтов в периапикальной ткани могут постепенно распадаться на более мелкие, которые, в свою очередь, могут вызывать типичную реакцию на инородное тело и активировать макрофаги. Известно, что последние дают сигнал межклеточным медиаторам, которые включают в себя провоспалительные цитокины и модуляторы, участвующие в резорбции кости.
Кроме того, коммерческие гуттаперчиевые штифты могут быть загрязнены раздражающими ткани веществами, что может вызвать реакцию на инородное тело в периапексе. В исследовании девяти бессимптомных персистирующих очагов апикального периодонтита, которые были получены путем хирургической биопсии и проанализированы с помощью корреляционной световой и просвечивающей электронной микроскопии, одна биопсия (рис. 3) выявила наличие контаминированной гуттаперчи.
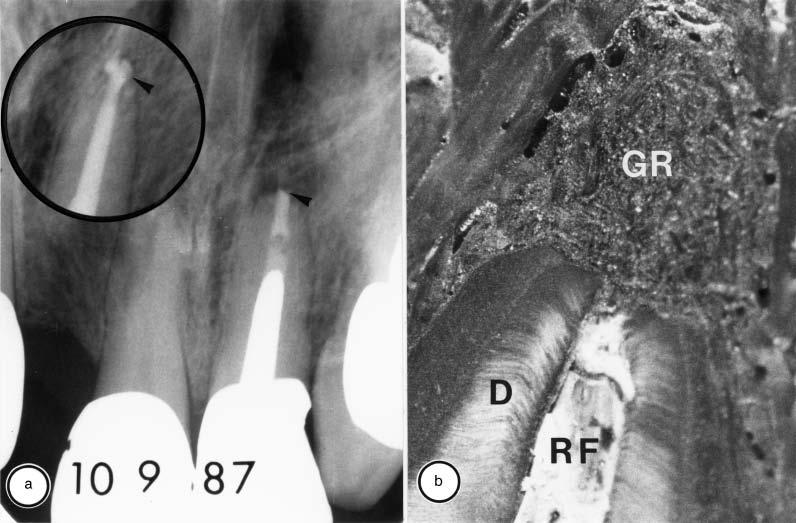
Рис. 3. Две рентгенограммы (вставка и а) левого центрального резца верхней челюсти с запломбированным каналом и периапикальным поражением у 54-летнего мужчины. Первая рентгенограмма (вставка), сделанная сразу после завершения лечения корневого канала в 1977 году, показывает небольшой избыток пломбировочного материала в периапексе (стрелка на вставке).
Обратите внимание, что избытка пломбировочного материала нет на рентгенограмме, сделанной 10 лет спустя (стрелка в а) и незадолго до вмешательства. В апикальной биопсии, взятой хирургически, не обнаружено избытка пломбировочного материала, как видно из макросъемки декальцинированного и разделенного аксиально фрагмента биоптата (b).
RF – запломбированный корневой канал; D - дентин; GR - гранулема. Исходное увеличение (b) 10.
Рентгенологически поражение сохранялось, было бессимптомным и увеличивалось в размерах в течение десяти лет наблюдения после лечения. Поражение характеризовалось наличием огромного количества многоядерных гигантских клеток с двулучепреломляющими включениями (рис. 4).
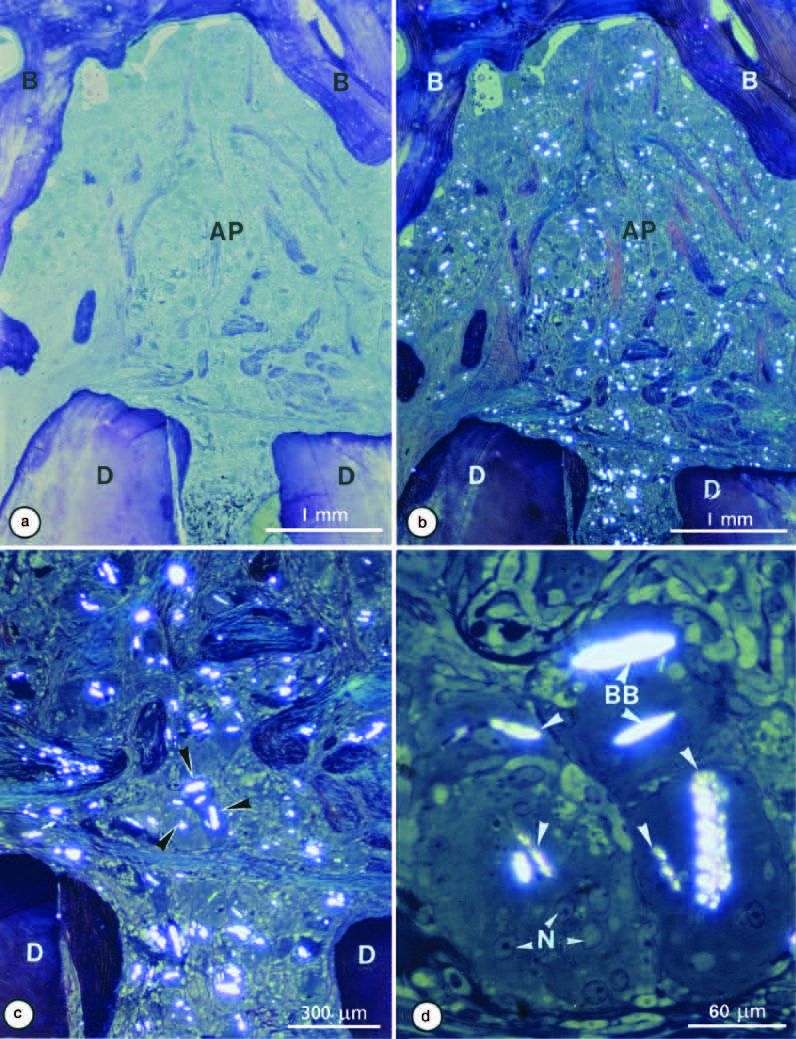
Рис. 4. Микрофотография в ярком поле внедренного пластмассового полутонкого (толщиной 2 мм) среза апикальной области, показанного на рис. 1b. Обратите внимание на обширный очаг апикального периодонтита (AP) (a). Такое же поле, если смотреть при поляризованном свете (b). Обратите внимание на двулучепреломляющие тельца, распределенные по всему поражению (b).
Апикальное отверстие увеличено на (c), а темные клетки в виде наконечников стрел на (c) дополнительно увеличены на (d).
Обратите внимание на двулучепреломление (BB), возникающее из щелевидных телец включения в многоядерных (N) гигантских клетках. B - кость; D - дентин.
Исходные увеличения: (a, b) 23; (c) 66; (d) 330.
Из: Nair PNR. Патология апикального периодонтита.
В: Ørstavik D, PittFord TR. eds. Essential Endodontology. Oxford: Blackwell, 1998.
При просвечивающей электронной микроскопии было обнаружено, что двулучепреломляющие тельца обладают высокой электронной плотностью (рис. 5).
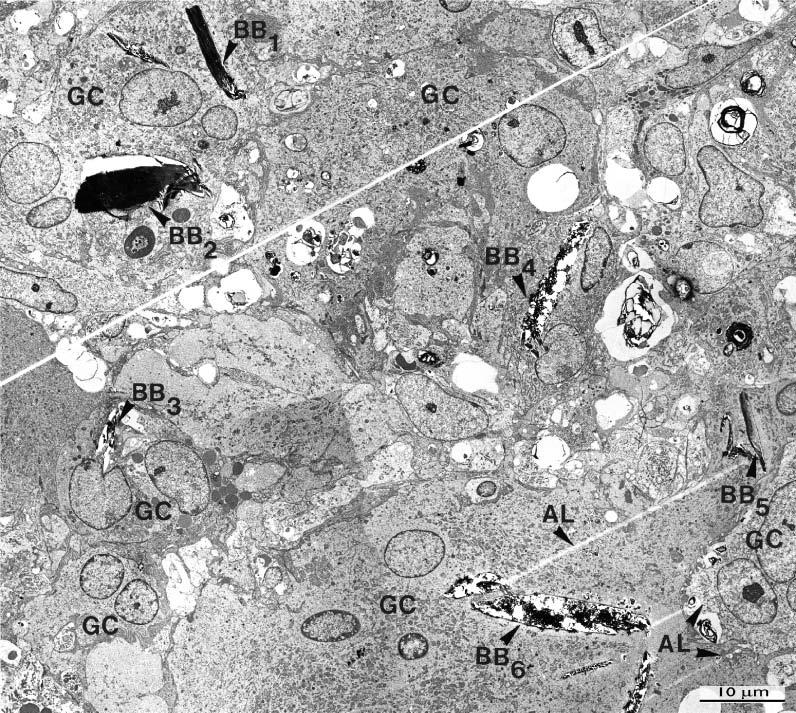
Рис. 5. Просвечивающая электронная микроскопия с небольшим увеличением, показывающая контуры нескольких гигантских клеток в очаге апикального периодонтита, показанные на рис. 3 и 4. Обратите внимание на наличие многих щелевидных телец включения (BB1-BB6), которые содержат материал с высокой электронной плотностью. Этот материал может оставаться нетронутым внутри тельца включения или может быть отодвинут от своего первоначального места (BB2), или может казаться распавшимся (BB3 и BB4) в результате обработки ткани.
Обратите внимание на линии AL, которые создаются частями электронно-плотного материала, оставляющего после себя участки.
Исходное увеличение × 1880.
Энергодисперсионный рентгеновский микроанализ включений с использованием сканирующей просвечивающей электронной микроскопии (STEM) выявил присутствие магния и кремния (рис. 6).
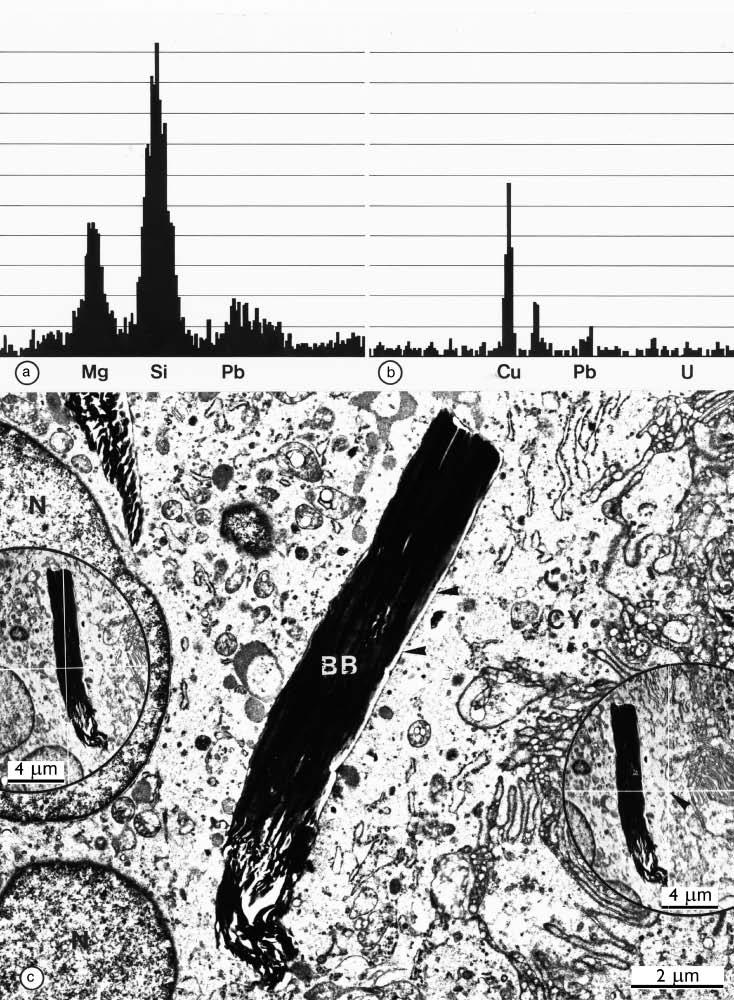
Рис. 6. Просвечивающая электронная микроскопия, большое увеличение (c) неповрежденного двулучепреломляющего тельца, помеченного BB1 на рис. 5. Обратите внимание на четкую разделительную мембрану вокруг двулучепреломляющего тельца (BB).
Микроанализ методом энергодисперсионной рентгеновской спектроскопии электронно-плотного материала, проведенный в сканирующем просвечивающем электронном микроскопе (в точке пересечения двух перпендикулярных друг другу линий на левой вставке), выявил присутствие кремния (Si), магния (Mg) и свинца (Pb) в (a), тогда как другой участок цитоплазмы той же гигантской клетки (стрелка на правой вставке) не показывает присутствия Si и Mg (b).
Свинец и уран (U) используются для контрастирования сечений, а излучение в меди (Cu) происходит от поддерживающей сечение сетки, изготовленной из меди.
Исходное увеличение ×11 000; вставки ×3300.
Эти элементы, по-видимому, являются остатками загрязненной тальком гуттаперчи, которая проникла в периапекс и рассосалась в течение периода наблюдения.
Пульсирующая гранулема полости рта
Пульсирующая гранулема полости рта представляет собой самостоятельное гистопатологическое образование. Она свидетельствует о реакции на инородное тело из-за частиц растительной пищи, в особенности семян бобовых, таких как горох, фасоль и чечевица (бобы), которые застревают в тканях полости рта.
Эти поражения также называют гигантоклеточной гиалиновой ангиопатией, растительной гранулемой и гранулемой, вызванной пищей.
Сообщалось о случаях пульсирующей гранулемы в легких, стенках желудка и брюшной полости. Экспериментальные поражения были вызваны у животных интратрахеальным, внутрибрюшинным и подслизистым введением семян бобовых.
Периапикальные пульсирующие гранулемы связаны с зубами, сильно пораженными кариесом, и с эндодонтически леченными зубами. Пульсирующая гранулема характеризуется наличием интенсивно йодиновых и кислотно-положительных гиалиновых колец/телец, окруженных гигантскими и воспалительными клетками.
Было предположено, что в растениях агентом, вызывающим гранулему, является целлюлоза. Тем не менее, наиболее часто гранулематозные поражения вызывают семена бобовых. Это указывает на то, что и другие компоненты бобов, такие как антигенные белки и митогенные фитогемагглютинины, также могут индуцировать патологический тканевой ответ.
Пульсирующие гранулемы имеют клиническое значение, поскольку частицы растительной пищи могут проникать в периапикальные ткани через корневые каналы зубов, сообщающиеся с полостью рта в результате травмы, кариеса или при эндодонтическом лечении.
Однако частота возникновения апикального периодонтита после лечения неизвестна, поскольку в литературе сообщалось только о двух таких случаях.
Целлюлозная гранулема
Целлюлозная гранулема - это термин, используемый специально для обозначения патологической реакции ткани на частицы преимущественно целлюлозосодержащих материалов, которые используются в эндодонтической практике. Эндодонтические бумажные пины применяются для взятия образцов микроорганизмов и для высушивания каналов.
Частицы этих термостерилизованных материалов могут быть легко перемещены или протолкнуты в периапикальные ткани, что индуцирует реакцию на инородное тело в периапикальной области. Поэтому крайне важно соблюдать осторожность во время клинических манипуляций с эндодонтическими бумажными пинами.
Сообщалось о наличии целлюлозных волокон в периапикальных биопсиях при ранее проводимом эндодонтическом лечении в анамнезе. Общая частота первичного или послеоперационного апикального периодонтита, вызванного целлюлозой, неизвестна. Отчасти это может быть связано с тем, что целлюлоза в периапикальных биопсиях незаметна и ее сложно идентифицировать без применения специальных красителей или микротехнологий. В двух гистопатологических исследованиях, в которых было изучено 13 биопсий из очагов апикального периодонтита, возникшего после лечения, во всех случаях был обнаружен материал, подобный волокнам целлюлозы.
Эндодонтические бумажные пины и вата состоят из целлюлозы, которая не переваривается в человеческом кишечнике и не разлагается клетками организма. Они остаются в тканях в течение длительного времени и вызывают их реакцию на инородное тело.
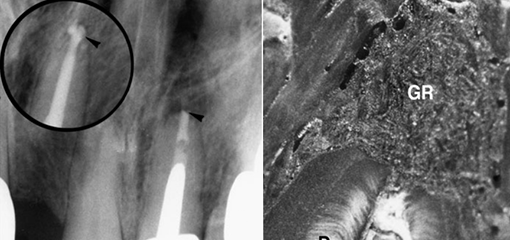
Частицы при рассмотрении в поляризованном свете дают двойное лучепреломление из-за правильной структуры молекул целлюлозы. Бумажные пины, инфицированные внутрикорневыми микроорганизмами, могут выходить через апикальное отверстие в периапикальные ткани (рис. 7) и позволяют биопленке обрастать вокруг штифта (рис. 7c, d). Это поддерживает и усугубляет апикальный периодонтит после лечения.
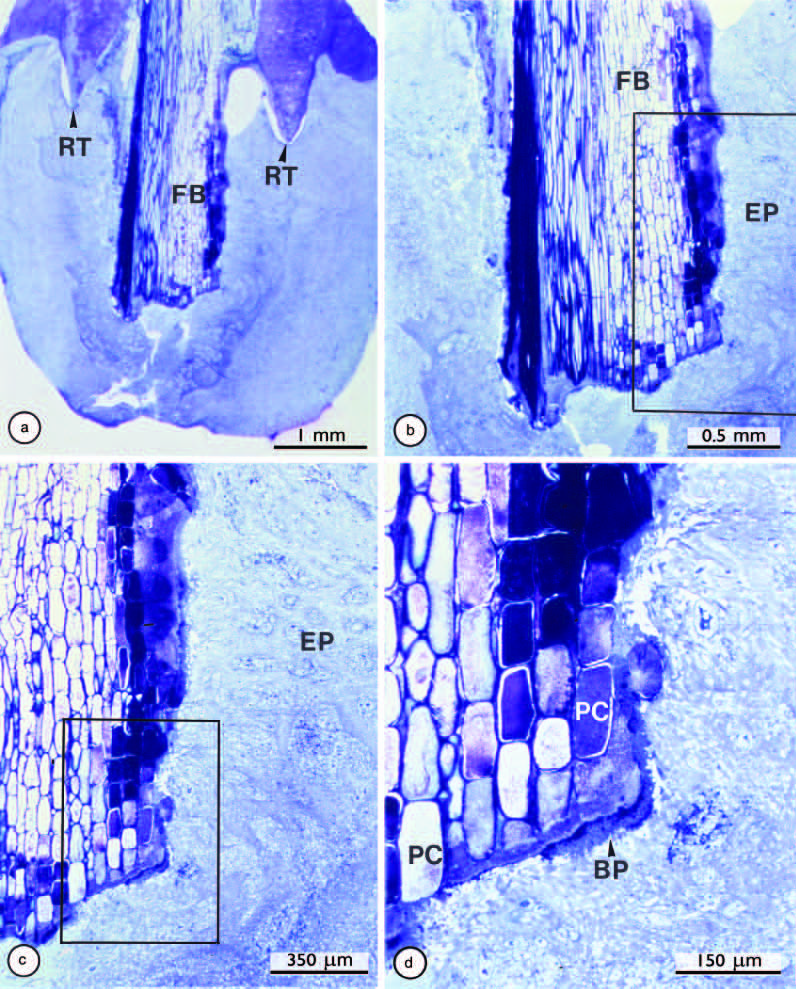
Рис. 7.
Массивная гранулема, индуцированная бумажным пином, поражающая пролеченный корневой канал зуба (а). Выделенная область в (b) увеличена в (c), а выделенная область в (с) дополнительно увеличена в (d).
Обратите внимание на кончик бумажного штифта (FB), выступающий за апекс в очаг периодонтита, и бактериальный налет (BP), адгезированный к поверхности бумажного пина. RT - кончик корня; EP - эпителий; PC - растительная клетка.
Исходное увеличение: (a) ×20; (b) ×40; (c) ×60; (d) ×150.
Из: Nair PNR. Патобиология периапекса. In: Cohen S, Burns RC. eds. Pathways of the Pulp, 8th edn. St Louis: Mosby, 2002.
Другие инородные материалы
Амальгама, эндодонтические силеры и соли кальция, образованные из выведенного периапикально гидроксида кальция {Ca(OH)2}, также встречаются в периапикальных тканях. При гистологическом и рентгенологическом микроаналитическом исследовании 29-ти апикальных биоптатов было обнаружено, что 31% образцов содержит материалы, совместимые с амальгамой и компонентами эндодонтических силеров.
Однако этиологическое значение этих материалов не было окончательно доказано экспериментально. Возможно, эти материалы могли сосуществовать с неидентифицированными этиологическими агентами, в данных случаях такими как наличие внутрикорневной инфекции.
Эндогенные вещества и реакция на инородное тело
Эндогенные вещества, раздражающие ткани, в основном имеют кристаллическую мелкодисперсную природу. Как эндогенные, так и экзогенные кристаллы индуцируют патологическую реакцию тканей, вызывая воспаление, опосредованное цитокинами, резорбцию твердых тканей и повреждение мягких тканей.
Эндогенные кристаллические вещества, которые, как было показано, вызывают патогенную реакцию тканей, включают урат натрия (при подагре), дигидрат фосфата кальция (при псевдоподагре), основный фосфат кальция (гидроксиапатит) и холестерин.
Хотя наличие кристаллов холестерина при апикальном периодонтите уже давно считается распространенным гистопатологическим признаком, его этиологическое значение для послеоперационного апикального периодонтита еще не полностью оценено.
Биология холестерола
Холестерол – это липид стероидного происхождения, присутствующий во всех животных тканях. Название происходит от Chole-stereos, что означает "твердая желчь", из-за его присутствия в желчных камнях. Холестерол был первым стероидом, чья структура была изучена.
Он имеет характерную сердцевину ‘циклопентанопергидрофенантренового’ кольца (рис. 8).
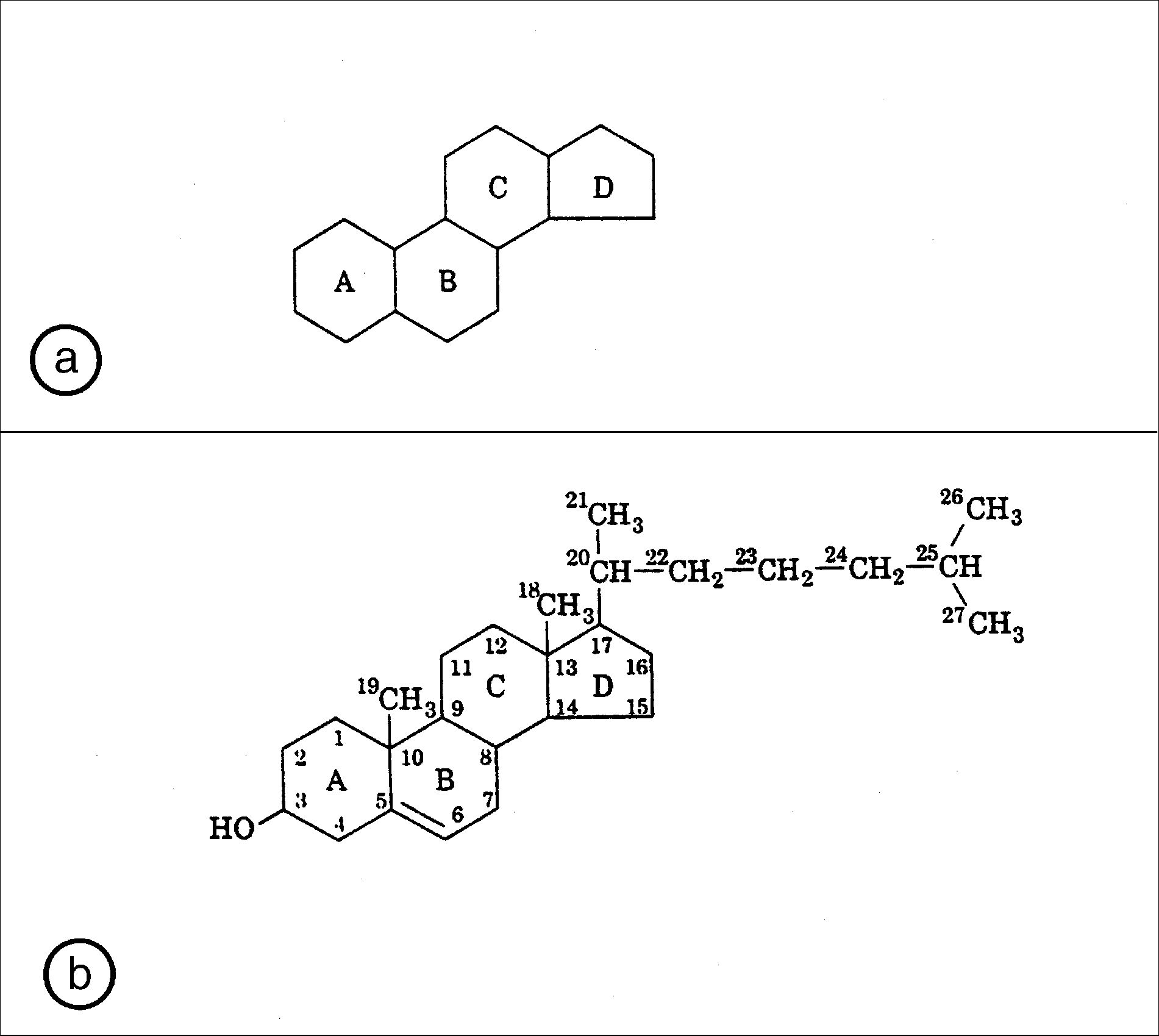
Рис. 8. Исходным соединением всех стероидов является циклопентанопергидрофенантрен с четырьмя насыщенными кольцами, которые обозначены, как показано (а), в алфавитном порядке.
Структурная формула холестерина (в). Обратите внимание на четыре циклогексановых кольца и стандартную систему нумерации всех атомов углерода
Холестерин является важным компонентом мембран животных клеток и определяет их свойства. Он в достаточном количестве содержится в "богатых мембранами" тканях (миелин) и клетках (секреторные клетки) и является предшественником желчных кислот, провитамина D3 и некоторых гормонов.
Холестерин для здоровья
Холестерин необходим для жизни, и большая часть холестерина в организме синтезируется в печени. Вся потребность организма в холестерине может быть удовлетворена за счет его эндогенной выработки. Тем не менее, холестерин из пищи всасывается в кишечнике и метаболизируется.
Холестерин, как и другие липиды, нерастворим в водном растворе. Следовательно, он транспортируется кровью в виде конъюгатов липопротеинов. Последние представляют собой шаровидные частицы, состоящие из ядра триглицеридов и сложных эфиров холестерина, которые окружены оболочкой из белков, фосфолипидов и холестерина. На основе их функциональных и физических свойств липопротеины были классифицированы на четыре основные категории: (i) хиломикроны, транспортирующие пищевой (экзогенный) холестерин из кишечника в ткани; (ii) липопротеины очень низкой плотности (ЛПОНП), переносящие эндогенный холестерин из печени в ткани; (iii) липопротеины низкой плотности (ЛПНП), транспортирующие холестерин из тканей в печень, и (iv) липопротеины высокой плотности (ЛПВП), способствующие удалению холестерина из тканей в печень.
Пищевой холестерин
Холестерин и другие пищевые липиды проходят через рот и желудок практически нетронутыми в процессе пищеварения. Отчасти это связано с нерастворимостью холестерина в водной среде. В тонком кишечнике холестерин эмульгируется путем захвата в мицеллы желчных солей, что делает его доступным для частичного переваривания ферментами и последующего всасывания клетками кишечника.
Поглощенный холестерин и триглицериды затем собираются клетками кишечника в самые крупные из липопротеиновых конъюгатов - хиломикроны. Через лимфо- и кровообращение хиломикроны транспортируются к тканям по всему телу. Они адгезируются к местам связывания на внутренней поверхности эндотелия капилляров в скелетных мышцах и жировой ткани, где удаляется большая часть триглицеридного компонента. В результате хиломикроны становятся меньше, больше по плотности и обогащаются содержанием холестерина. Это остатки хиломикрона, которые отделяются от эндотелия капилляров, чтобы снова попасть в кровоток.
При попадании в печень большая часть экзогенного холестерина в остатках хиломикрона используется печенью для образования желчных солей или смешивается с холестерином, синтезируемым печенью, для экспорта в отдаленные органы и ткани.
Эндогенный холестерин
Гепатоциты синтезируют холестерин из уксусной кислоты. Этот эндогенный холестерин смешивается с частью экзогенного холестерина, поступающего в виде остатков хиломикронов, переупаковывается в ЛПОНП и доставляется в ткани через кровь. Когда ЛПОНП проходит через ткани, клетки разрушают его путем частичного потребления некоторых его компонентов. Следовательно, уровень ЛПОНП постепенно меняется. Он уменьшается в размерах, но увеличивается в плотности, превращаясь в липопротеин промежуточной плотности (ЛППП), который является переходным липопротеином в липидном обмене.
ЛППП в конечном итоге попадает в кровоток, где они превращаются в ЛПНП, основной компонент переносимого с кровью транспорта холестерина из тканей в печень. Известно, что он непосредственно участвует в образовании бляшек на стенках сосудов, которые в конечном итоге приводят к атеросклерозу. Поэтому ЛПНП в народе называют ‘плохим’ холестерином.
ЛПНП образуется из ЛППП под действием ЛПВП, который присутствует в крови. В отличие от других типов липопротеинов, ЛПВП собирается и высвобождается в кровоток клетками внепеченочной ткани из компонентов, в значительной степени полученных в результате распада других липопротеинов и клеточных мембран. ЛПВП функционирует как «поглотитель» холестерина и имеет важнейшее значение для выведения холестерина из тканей в печень. Эта способность в значительной степени полезна организму. Поэтому ЛПВП известен как ‘хороший’ холестерин.
Как указывалось ранее, одним из важных продуктов холестерина являются соли желчных кислот, которые способствуют всасыванию пищевого холестерина и жира в кишечнике. Большая часть желчных солей утилизируется и перерабатывается в кишечнике. Однако, поскольку соли желчных кислот не реабсорбируются на 100%, небольшое количество солей желчных кислот выводится из организма.
В толстом кишечнике соли желчных кислот восстанавливаются бактериями до копростерола, который является единственной формой, в которой холестерин выводится из организма, а печень является единственным органом, способным выводить значительные количества холестерина.
Холестерин при заболеваниях
Предполагается, что избыточный уровень холестерина в крови играет определенную роль в развитии атеросклероза в результате его отложения в стенках сосудов. Он характеризуется атеромами, при разрезе которых выделяется кремово-желтое вещество, богатое эфирами холестерина.
Атеросклероз - это хроническое, прогрессирующее, многофакторное заболевание, которое начинается как внутриклеточное отложение холестерина в ранее поврежденных участках внутренних стенок артерий. Поражения в конечном итоге превращаются в волокнистые кальцинированные бляшки. Последующее склерозирование и сужение артерий способствуют образованию внутрисосудистых тромбов и инфаркту кровоснабжаемой ткани.
Хотя атерома может развиваться во многих различных кровеносных сосудах, чаще всего она встречается в коронарных артериях. Возникающий в результате инфаркт миокарда обычно приводит к летальному исходу и является наиболее распространенной причиной смерти в западных промышленно развитых странах. Локальное отложение кристаллического холестерина также происходит в других тканях и органах, как в случае среднего отита и ‘жемчужной опухоли’ черепа. В полости рта накопление кристаллов холестерина происходит при очагах апикального периодонтита, имеющих клиническое значение в эндодонтии и челюстно-лицевой хирургии.
Холестерин при апикальном периодонтите
Очаги апикального периодонтита часто содержат отложения кристаллов холестерина, проявляющиеся на гистопатологических срезах как узкие, удлиненные щели в ткани. Кристаллы растворяются в жировых растворителях, используемых для обработки тканей, после этого остаются пространства в виде щелей. Распространенность щелей от холестерина при апикальном периодонтите колеблется от 18% до 44%.
Считается, что кристаллы образуются из холестерина, выделяемого: (i) распадающимися эритроцитами застойных кровеносных сосудов в пределах поражения, (ii) лимфоцитами, плазматическими клетками и макрофагами, которые в большом количестве погибают и распадаются при хронических периапикальных поражениях и (iii) циркулирующими липидами плазмы.
Все эти источники могут способствовать накоплению и кристаллизации холестерина в периапикальной области. Тем не менее, клетки воспаления, которые погибают и распадаются внутри очага поражения, могут быть основным источником холестерина в результате его высвобождения из кеточных мембран при длительно персистирующих поражениях. Кристаллы первоначально образуются в воспаленной периапикальной соединительной ткани, где они воспринимаются как инородные тела и провоцируют реакцию гигантских многоядерных клеток.
На гистологических срезах вокруг холестериновых щелей можно наблюдать многочисленные многоядерные гигантские клетки (рис. 9). Когда в воспаленной соединительной ткани скапливается большое количество кристаллов, они пассивно движутся в направлении наименьшего сопротивления. Если поражением является радикулярная киста, кристаллы перемещаются в направлении полости кисты, выстланной эпителием, поскольку через внешнюю коллагеновую капсулу прохождение кристаллов затруднено. Медленное ‘ледниковое’ движение массы кристаллов разрушает эпителиальную оболочку и кристаллы заполняют полость кисты (рис. 9).
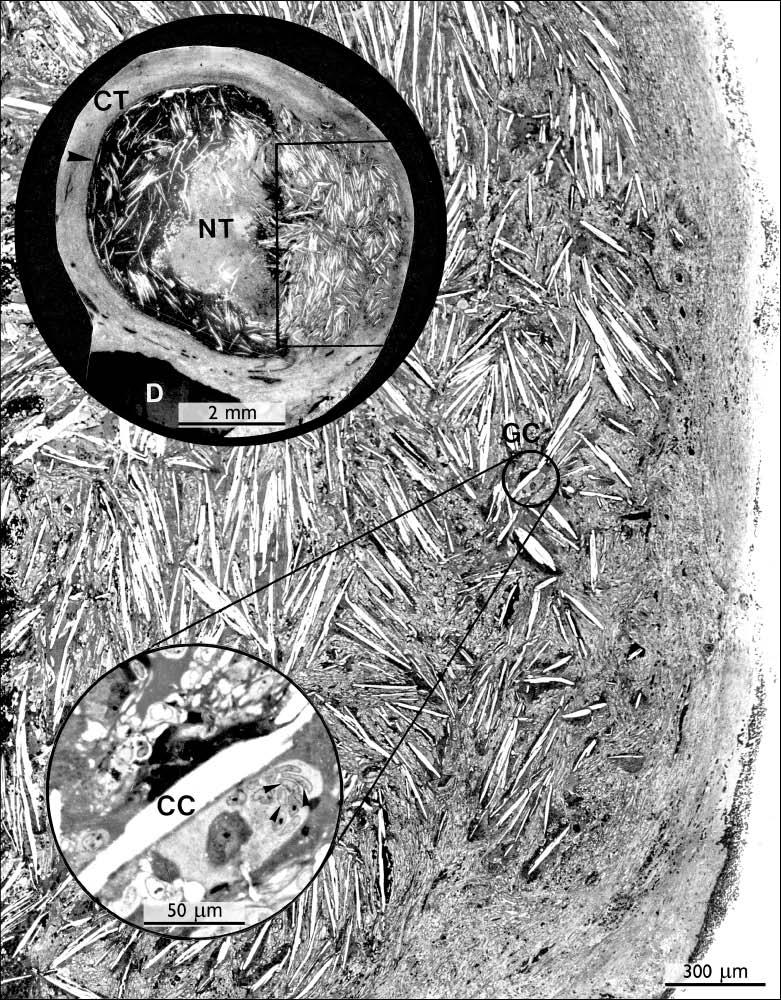
Рис. 9. Кристаллы холестерина и радикулярная киста как потенциальные причины неудач эндодонтии.
Обзор гистологического среза (верхняя вставка) бессимптомного апикального периодонтита, который сохранялся после обычного лечения корневых каналов. Обратите внимание на огромное количество холестериновых щелей (CC), окруженных гигантскими клетками (GC), из которых выбранная с несколькими ядрами (наконечниками стрел) увеличена на нижней вставке. D - дентин; CT - соединительная ткань; NT - некротическая ткань.
Исходное увеличение: ×68; верхняя вставка ×11; нижняя вставка × 412.
Из: Nair PNR. Aust Endod J 1998: 25: 19-26.
Радикулярные кисты и апикальные гранулемы, в которых в основном наблюдаются холестериновые щели, называются ‘холестеатомой’. Термин происходит от общей патологии - местное накопление кристаллов холестерина, которые вызывают дискомфорт и дисфункцию пораженных органов. Поэтому было предложено использовать его более конкретно, как "апикальную холеастому", чтобы отличать данное состояние от холестеатомы, поражающей другие ткани и органы.
Реакция на холестерин in vivo
Было проведено несколько исследований на животных, направленных на изучение реакции тканей на кристаллы холестерина и роль кристаллов в сердечно-сосудистых заболеваниях. Кристаллы холестерина обладают интенсивной склерогенностью. Было показано, что они вызывают гранулематозные поражения у собак, мышей и кроликов.
Холестерин применяли в этих исследованиях путем прямого введения его суспензии в стенки артерий, путем подкожного отложения кристаллов холестерина или путем подкожной имплантации рассасывающейся желатиновой губки, которая была пропитана холестерином в эфире, и растворителю перед имплантацией дали испариться. Эти исследования последовательно показали, что кристаллы холестерина были плотно окружены макрофагами и гигантскими клетками.
Насколько известно автору, в литературе сообщается только об одном экспериментальном исследовании, в котором конкретно рассматривалась потенциальная связь кристаллов холестерина и длительно персиситирующих очагов апикального периодонтита. В этом исследовании in vivo на морских свинках реакция тканей на кристаллы холестерина была изучена с использованием модели тефлонового кейджа, которая облегчала целостное хирургическое извлечение кристаллов из окружающих тканей хозяина после эксперимента.
Исследование было разработано, чтобы ответить на вопрос о том, будут ли агрегаты кристаллов холестерина вызывать и поддерживать гранулематозную тканевую реакцию у морских свинок. Чистые кристаллы холестерина, приготовленные до кашицеобразной формы, помещали в тефлоновые кейджи, которые имплантировали подкожно морским свинкам. Содержимое кейджа извлекали через 2, 4 и 32 недели после имплантации и обрабатывали для световой и электронной микроскопии.
В кейджах обнаружилась нежная мягкая соединительная ткань, которая проросла через отверстия в стенке кейджа. Кристаллы были плотно окружены многочисленными макрофагами и многоядерными гигантскими клетками (рис. 10 и 11), образуя четко очерченную область тканевой реакции. Клетки, тем не менее, не смогли ликвидировать кристаллы за 8 месяцев. Реакция тканей на кристаллы холестерина, наблюдаемая в ходе исследования, полностью соответствовала результатам предыдущих морфологических исследований.
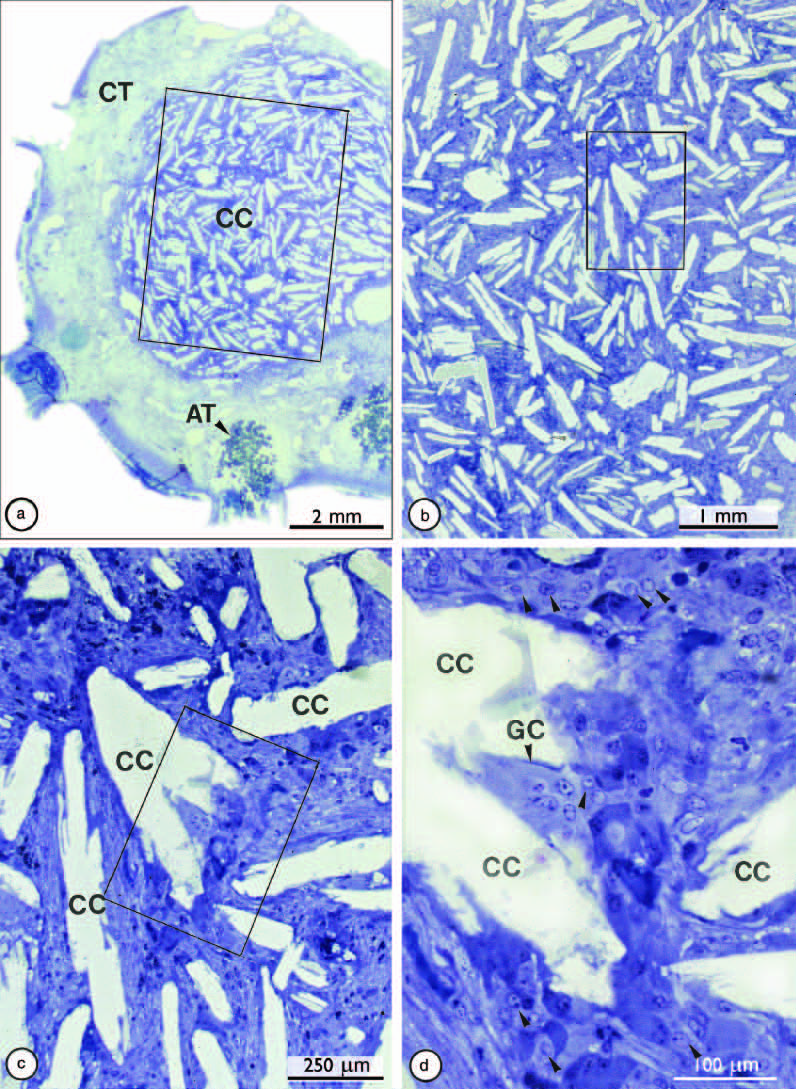
Рис. 10. Микрофотография (а) реакции тканей морской свинки на скопления кристаллов холестерина после тридцати двух недель наблюдения. Прямоугольные разграниченные области в (a), (b) и (c) увеличены в (b), (c) и (d) соответственно. Обратите внимание на ромбовидные трещины, оставленные кристаллами холестерина (CC), окруженными гигантскими клетками (GC) и многочисленными мононуклеарными клетками (стрелки в d). АТ - жировая ткань; СТ - соединительная ткань.
Исходное увеличение: (a) ×10; (b) × 21; (c) ×82; (d) ×220.
Из: Nair PNR. Aust Endod J 1998: 25: 19–26.
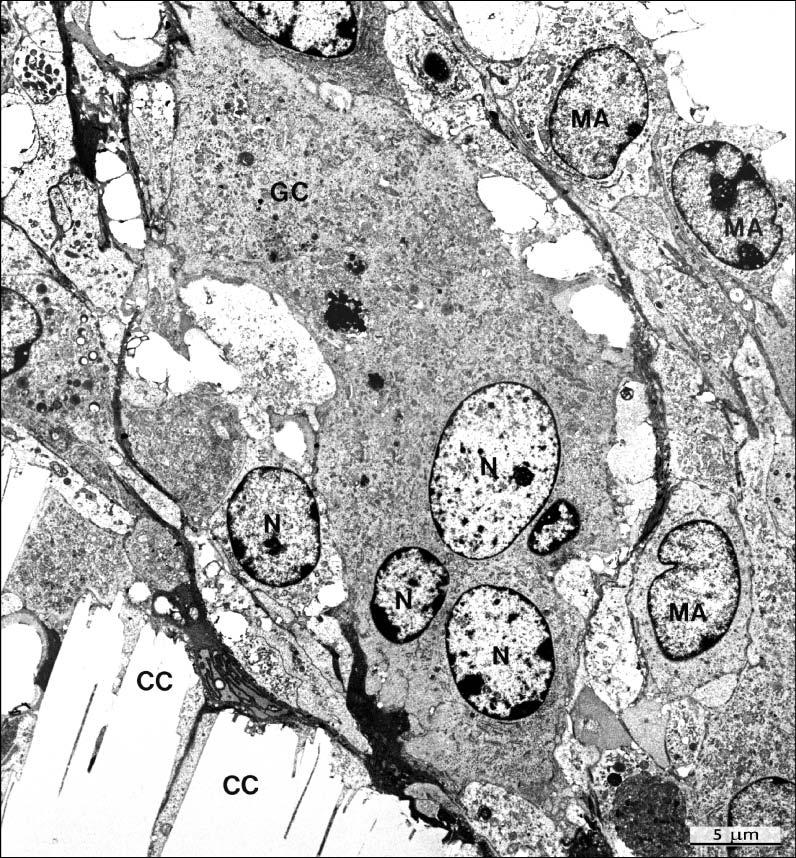
Рис. 11. Ультраструктура реакции ткани морской свинки на кристаллы холестерина (CC) в кейджах, которые были извлечены через 32 недели после имплантации. Обратите внимание на большие многоядерные (N) гигантские клетки (GC) и многочисленные макрофаги (MA) вокруг кристаллов.
Исходное увеличение ×4600.
Из: Nair PNR, Aust Endod J 1998: 25: 19–26
Скопление макрофагов и гигантских клеток вокруг кристаллов холестерина при отсутствии других клеток воспаления, таких как нейтрофилы, лимфоциты и плазмоциты, позволяет предположить, что кристаллы индуцировали типичную реакцию на инородное тело. В то время как большинство макрофагов могут быть недавними предшественниками моноцитов крови, гигантские клетки имеют местное происхождение.
Исследования радиоактивного мечения убедительно показали, что гигантские клетки являются производными моноцитов, образованными слиянием макрофагов. Исследования цитогенеза многоядерных гигантских клеток вокруг кристаллов холестерина в подкожных имплантатах предполагают, что они образуются в результате процесса ‘окружения’ макрофагов вокруг отдельных кристаллов.
После формирования гигантские клетки также могут увеличиваться в размерах за счет синхронного деления их ядер.
Клетки организма не могут ликвидировать кристаллы холестерина
Клинический интерес представляет знание того, в какой степени клетки организма способны ликвидировать локально накопленные кристаллы холестерина. Их устранение должно происходить фагоцитарным и/или биохимическим путями.
В дополнение к основной роли макрофагов в иммунологической защите и воспалении, они являются эффективными фагоцитами, способными поглощать и убивать микроорганизмы, убирать мертвые клетки и некротическую ткань и удалять мелкие инородные частицы.
Клетки, относящиеся к мононуклеарной фагоцитарной системе, участвуют в поглощении липидов. Было показано, что макрофаги усваивают кристаллы холестерина in vitro. Мелкие суспензии кристаллов холестерина, вводимые интраперитонеально крысам, были обнаружены в макрофагах грудных лимфатических узлов. При этом размеры кристаллов должны были быть достатостаточно малы для возможности их поглощения макрофагами.
Тем не менее, когда макрофаги сталкиваются с более крупными инородными частицами или кристаллами холестерина, они превращаются в многоядерные гигантские клетки. Присутствие гигантских клеток в холестериновой гранулеме ясно указывает на то, что макрофаги столкнулись с более крупными кристаллами холестерина, чем они сами. Однако, гигантские клетки - слабые фагоциты: эффективность их фагоцитоза снижается с увеличением размера клеток.
Уничтожительная способность многоядерных гигантских клеток в основном обусловлена их способностью резорбировать внутренние и внешние субстраты. Резорбция - это высокоспециализированная деятельность клеток, при которой деструкция соответствующих субстратов происходит внеклеточно на специализированной границе клетка/субстрат биохимическими путями.
Чтобы утилизировать отложения кристаллов холестерина в тканях, окружающие клетки должны обладать способностью химически воздействовать на кристаллы, чтобы распространить их в окружающей тканевой жидкости или сделать их доступными для самих клеток. Кристаллы холестерина обладают высокой гидрофобностью, и для их диспергирования потребуется сделать их гидрофильными и "растворимыми" в водной среде.
Гранулематозное и склерогенное действие кристаллов холестерина можно предотвратить путем введения фосфолипидов в подкожные имплантаты холестерина. Этот благотворный эффект фосфолипидов объясняется их ‘детергентным’ свойством и их ролью в качестве доноров полиненасыщенных жирных кислот во время этерификации холестерина. Известно, что гигантские клетки и макрофаги этерифицируют и мобилизуют холестерин в форме липидных капель.
Макрофаги могут преобразовывать дисперсный холестерин в растворимую форму путем включения его в липопротеиновый носитель, так что холестерин может быть легко этерифицирован или добавлен в циркуляцию липопротеинов.
Эти результаты клеточной биологии, очевидно, подтверждают возможную способность макрофагов и гигантских клеток расщеплять холестерин в виде частиц. Но они не согласуются с гистопатологическими наблюдениями спонтанных и экспериментально индуцированных холестериновых гранулем. Характерной особенностью таких поражений является накопление макрофагов и гигантских клеток вокруг холестериновых щелей и их сохранение в течение длительного времени.
Следовательно, разумно предположить, что макрофаги и многоядерные гигантские клетки, которые собираются вокруг кристаллов холестерина, не способны разрушать кристаллы способом, выгодным для хозяина. Именно в этом контексте следует интерпретировать клиническое значение массивного накопления кристаллов холестерина в очагах апикального периодонтита. Макрофаги и гигантские клетки, окружающие кристаллы холестерина, не только не способны разрушать кристаллический холестерин, но и являются основными источниками медиаторов апикального воспаления и резорбции кости.
Экспериментально показана костная резорбирующая активность макрофагов, подвергшихся воздействию холестерина, за счет усиленной экспрессии IL-1a. Основываясь на этих соображениях, в ходе долговременного наблюдения за пациентом был сделан вывод, что "наличие огромного количества кристаллов холестерина было бы достаточным для поддержания очага на неопределенный срок".
Результаты экспериментов на животных и другие данные, представленные в литературе, подтверждают это предположение.
Клиническая значимость и заключительные комментарии
Поскольку внутрикорневая инфекция является первичной и основной причиной апикального периодонтита, целью стандартного эндодонтического лечения является устранение инфекционных агентов из корневого канала и предотвращение повторного инфицирования путем пломбирования корня. Однако тканевая динамика апикального периодонтита, сохраняющегося из-за реакции на инородное тело, не зависит от присутствия или отсутствия инфекционных агентов или других раздражителей в корневом канале. Макрофаги и гигантские клетки, которые накапливаются в местах реакции на инородное тело, не только не способны расщеплять инородные материалы и эндогенные вещества, которые поддерживают реакцию, но также являются основными источниками воспалительных и костно-резорбтивных цитокинов и других медиаторов.
Имеются клинические и гистологические доказательства того, что присутствие раздражающих ткани инородных материалов в периапикальном пространстве, таких как экструдированные материалы для пломбирования корней, эндодонтические бумажные пины, частицы пищевых продуктов и скопление кристаллов эндогенного холестерина, отрицательно влияют на заживление периапикальных тканей после лечения. Общая распространенность реакции инородного тела на периапекс в настоящее время неизвестна, но такие случаи могут быть очень редкими. Тем не менее, эндодонтические клинические ситуации, связанные с инородными телами, могут привести к "длительному неприятному и запутанному ходу событий".
Следовательно, можно сделать вывод, что инициирование реакции на инородное тело в периапикальных тканях экзогенными материалами или эндогенным холестерином задерживает или предотвращает восстановление после лечения.
В хорошо пролеченных зубах с адекватной обтурацией повторное ортоградное лечение вряд ли решит проблему, поскольку оно не удаляет раздражающие тела и вещества, находящиеся за пределами корневого канала. В настоящее время клинический дифференциальный диагноз на наличие этих экстрарадикулярных агентов апикального периодонтита, возникающего после лечения, невозможен. Кроме того, подавляющее большинство случаев апикального периодонтита после лечения вызвано инфекцией, сохраняющейся в сложной апикальной части системы корневых каналов.
Не гарантируется, что другое ортоградное перелечивание хорошо пролеченного зуба может устранить внутрикорневую инфекцию.
Поэтому клиницист, столкнувшийся с пациентом, у которого после лечения наблюдается бессимптомная, стойкая периапикальная рентгенологическая деструкция костной ткани, должен рассмотреть необходимость удаления внекорневых раздражающих факторов путем апикальной хирургии для лучших отдаленных результатов лечения.
Хирургическое лечение обеспечивает не только возможность устранения внекорневых агентов, которые поддерживают апикальную рентгенологическую деструкцию костной ткани после лечения, но также позволяет ретроградно подойти к любой потенциальной инфекции в апикальной части системы корневых каналов, которая также может быть устранена или загерметизирована на апексе пломбированием.
Источник: Endodontic Topics 2003, 6, 114–134
Похожие статьи:
Постэндодонтическое периапикальное поражение: гистологические и этиопатогенетические аспекты
Celia Carrillo García, Francisco Vera Sempere, Miguel Peñarrocha Diago, Eva Martí Bowen
Celia Carrillo García, Francisco Vera Sempere, Miguel Peñarrocha Diago, Eva Martí Bowen
О причинах хронического апикального периодонтита: обзор
Nair P.N.R
Nair P.N.R
Лечение обширного апикального очага с открытым апексом без использования хирургического подхода
Saurabh Doshi
Saurabh Doshi
Конденсация гуттаперчи непрерывной волной
Calogero Bugea
Calogero Bugea
Клинический случай лечения перфорации с применением кальций силикатного цемента и внутренней матрицы
Jaya Srivastava, Manoj Kumar Hans, Rohit Paul, Amit Kumar Garg, Rhitu Shekhar
Jaya Srivastava, Manoj Kumar Hans, Rohit Paul, Amit Kumar Garg, Rhitu Shekhar
Активация ирригационных растворов в эндодонтической практике
Станислав Геранин
Станислав Геранин
Авторский взгляд на проблему сломанных инструментов
Михаил Соломонов
Михаил Соломонов
От эндодонтии к реставрации
Максим Белоград
Максим Белоград
Эндодонтия без правил
Максим Белоград
Максим Белоград
Дезинфекция при перелечивании корневых каналов: беспроводная революция
Риккардо Тонини
Риккардо Тонини
Применение конусно-лучевой компьютерной томографии при эндодонтическом лечении анатомически слитых второго и третьего моляров нижней челюсти
Риккардо Тонини, Andreas Krokidis
Риккардо Тонини, Andreas Krokidis
Совершенствование апексификации - клинические случаи с успешным формированием верхушки у молодых пациентов
Rico Short
Rico Short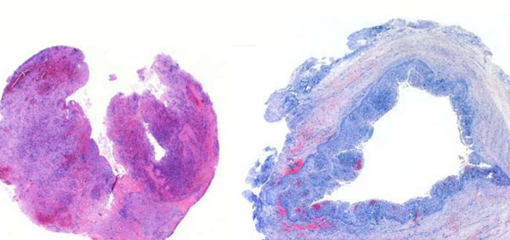
 В раздел статьи
В раздел статьи